 |
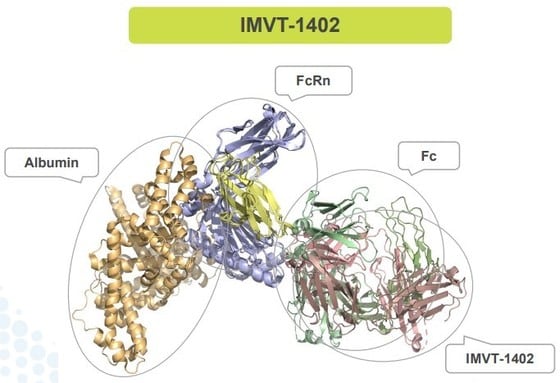
| FcRn에 결합한 HL161ANS(IMVT-1402) 구조.(이뮤노반트 제공) |
한올바이오파마(009420)와 미국 파트너사 이뮤노반트가 차세대 항FcRn 후보물질 개발에 속도를 내고 있다. 자가면역질환 치료제로 개발 중인 ‘HL161ANS(IMVT-1402)’ 임상 1상시험에서 긍정적인 데이터를 확인하면서다. 후속 임상시험 순항 시 210조원 규모의 자가면역질환 치료제 시장 공략에 탄력이 붙을 전망이다.
◇항FcRn 신약 후보 ‘HL161ANS’, '계열내최고' 신약 개발 기대2일 업계에 따르면 이뮤노반트는 지난달 26일(현지시간) 자가면역질환 치료제로 개발 중인 항FcRn 신약 후보물질 HL161ANS의 임상 1상 초기 데이터를 발표했다.
이번 임상 1상은 건강한 참가자를 대상으로 HL161ANS 피하주사제형(SC)을 300㎎, 600㎎ 등 2가지 용량으로 투여하는 단회용량상승시험(SAD)과 각 용량을 주 1회 4주간 투여해 적정용량을 평가하는 다중용량상승시험(MAD)이다.
단회용량상승시험 결과 HL161ANS는 기존 항FcRn 후보물질 ‘바토클리맙’과 유사하거나 높은 수준의 항체 저해 효능을 나타냈다. 안전성 부문에서 발생한 모든 부작용은 경증 또는 중등도 수준을 나타냈다. 모든 관찰시점에서 LDL-콜레스테롤 증가와 알부민 수치 감소와 관련해 통계적으로 유의미한 변화가 확인되지 않았다.이뮤노반트는 다중용량상승시험 결과 중 300㎎ 투여 데이터도 공개했다. HL161ANS 300㎎을 주 1회 4주간 투약한 결과, 혈중 항체가 약 63% 감소했다. 알부민 감소나 콜레스테롤 상승은 관찰되지 않았다. 중대한 부작용 도 없었다. HL161ANS 600㎎ 다중용량상승시험은 최근 개시됐다. 이뮤노반트는 오는 11월 관련 결과를 추가로 발표할 예정이다.
한올바이오파마와 이뮤노반트는 이번 임상 1상 결과 분석을 통해 HL161ANS의 '계열내최고'(Best-in-class) 개발 가능성을 확인하고 연구에 속도를 낼 방침이다.
◇210조원 규모 자가면역질환 치료제 시장, 차세대 주자로 항FcRn 부각
글로벌 시장조사기업 리서치앤마켓에 따르면 전 세계 자가면역질환 치료제 시장은 지난 2017년 1090억달러(약 150조원)에서 오는 2025년 1530억달러(약 210조원)로 성장할 것으로 전망된다. 예상 연평균 성장률은 4.2%다.
자가면역질환은 인체를 지키는 면역체계가 정상세포나 조직 등을 적으로 인식해 공격하는 질환이다. 이상반응으로 염증 등이 나타날 수 있다. 주요 질환으로는 류마티스관절염, 건선, 크론병, 원형탈모 등으로 자가면역질환으로 구분되는 질환 수는 80여가지다.
대표적인 자가면역질환 치료제는 TNF-α 억제제 계열 약물 ‘휴미라’(성분명 아달리무맙)가 있다. 글로벌 제약사 애브비가 개발한 휴미라는 지난해 매출 212억3700만달러(약 29조원)를 기록한 블록버스터 의약품이다.
항FcRn 의약품은 차세대 자가면역질환 치료제로 기대를 받는 약물 계열이다. 앞서 미국 식품의약국(FDA)과 유럽의약품청(EMA) 등으로부터 허가를 받은 약물로는 네덜란드 제약사 아제넥스의 ‘비브가르트’가 있다.
FcRn은 면역체계에서 기능하는 면역글로불린G(IgG)과 알부민 단백질의 회전율을 조절하는 역할을 하는 것으로 알려졌다. IgG는 자가면역질환을 유발할 수 있는 인자 중 하나다. 항FcRn 치료제는 IgG와 FcRn의 상호작용을 줄여 과도한 자가면역을 감소시키는 기전을 나타낸다. TNF-α 억제제에 반응하지 않거나 내성을 보이는 환자들에게도 치료 효과를 보일 것으로 전망된다.
한올바이오파마의 첫 번째 항FcRn 신약 후보물질 ‘바토클리맙’ 개발도 순항 중이다.
이뮤노반트는 그레이브스병(GD)에 대한 바토클리맙 임상 2상을 독일에서 개시했다. 올해 4분기 초기 데이터를 도출할 계획이다.
염증성 탈수초성 다발성신경병증(CIDP)에 대한 바토클리맙 임상 2b상은 2024년 상반기에 초기 데이터 결과가 나올 것으로 전망된다. 중증근무력증(MG) 임상 3상 탑라인 결과는 2024년 하반기에 확보될 전망이다. 갑상선 안병증(TED)에 대한 임상 3상 탑라인 결과는 2025년 상반기에 얻을 것으로 예상된다.
한올바이오파마의 바토클리맙 중국 파트너사 하버바이오메드는 MG 환자를 대상으로 진행한 임상 3상에서 긍정적인 탑라인 결과를 확보했다. MG환자 132명을 대상으로 진행된 임상에서 1차평가지표와 2차평가지표가 충족됐다.
하버바이오메드와 CSPC제약그룹은 중국 국가약품감독관리국(NMPA)에 바토클리맙 품목허가를 위한 바이오의약품 신약승인신청서(BLA)를 제출할 방침이다.
엄민용 현대차증권 연구원은 “항FcRn 항체가 기존 TNF-α 억제제 등에 대해 치료 반응이 없던 질환 환자들을 대상으로도 효과를 보인다면 아직까지 치료가 불가능한 중증 자가면역 적응증들을 치료할 수 있을 것”이라면서 “적응증 확장성이 수조원의 매출을 보일 것으로 기대되는 이유”라고 분석했다.
jin@news1.kr













![명품 주얼리 착용한 송혜교, 보석보다 빛나는 비주얼 [N화보]](https://image.news1.kr/system/photos/2024/5/17/6654086/no_water.jpg/dims/resize/276/crop/276x184/thumbnail/138x92!/optimize)