 |
| © News1 김초희 디자이너 |
미국 식품의약국(FDA)이 이달 중 헬리코박터 감염증 치료제 등 최소 7개 약물에 대한 신약 허가 또는 적응증 확대 여부를 결정할 예정이다.
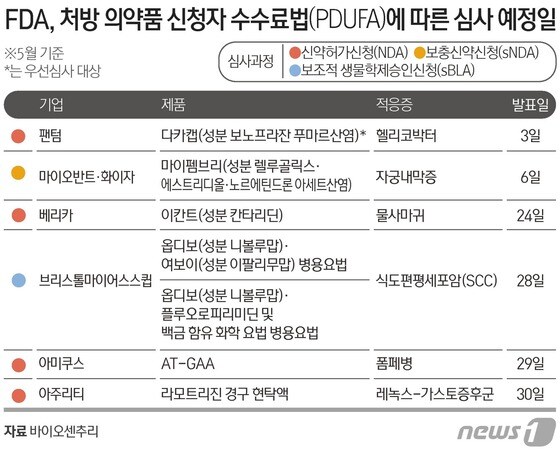
2일 미국 바이오센추리는 허가신청자비용부담법(PDUFA)에 따라 FDA가 이달 중 최소 7개 약물에 대한 심사 결과를 발표할 예정이라며 그중 신약 후보는 4건, 나머지 3개 후보는 적응증 확장을 모색 중이라고 보도했다.바이오센추리에 따르면 신약후보 중 1개는 우선심사 대상이다.
FDA는 기존 치료법에 비해 효과가 크게 개선될 것으로 기대되면 우선심사 대상으로 선정해 승인 여부를 6개월 안으로 결정해 통보한다.
우선 FDA는 오는 3일 미국 팬텀 파마수티컬스가 개발한 헬리코박터 파일로리 감염 치료제 '다카캡(성분 보노프라잔 푸마르산염)'에 대한 신약승인신청(NDA) 결과를 발표한다. 팬텀에 따르면 지난 4월 공개한 임상3상에서 다카캡은 경쟁 제품인 피리박시드에 비해 비열등성과 우수한 박멸률을 보이여 주요 효능평가 기준을 충족했다. 다카캡은 위벽세포의 프로톤펌프(H+/K ATPase)를 막아 위산 분비를 억제하는 경구용 저분자 차단제다.
팬텀에 이어 6일에는 스위스 마이오반트와 다국적제약사 화이자가 개발한 '마이펨브리(성분 렐루골릭스·에스트리디올·노르에틴드론 아세트산염)'에 대한 보충신약신청(sNDA) 허가 여부가 결정된다.
마이펨브리는 중등도에서 중증 자궁내막증 통증을 치료하는 치료제다. 앞서 FDA로부터 폐경 전 여성의 자궁근종과 관련된 심한 생리 출혈 치료제로 승인받았다. 바이오센추리는 지난 4월 12일 FDA가 마이펨브리에 sNDA 신청에 대한 결함을 확인했다고 밝혔으나 세부 사항은 공개하지 않았다고 설명했다.
브리스톨마이어스스큅(BMS)은 절제 불가능한 진행성, 재발성 또는 전이성 식도편평세포암 1차 치료를 위해 자사 면역항암제 '옵디보(성분 니볼루맙)'에 대한 두 가지 병용요법의 PDUFA 발표를 기다리고 있다.
FDA는 오는 28일 옵디보와 다른 면역항암제 '여보이(성분 이팔리무맙)' 그리고 옵디보와 플루오로피리미딘 및 백금 함유 화학요법의 병용요법에 대한 보조적생물학제승인신청(sBLA) 심사 결과를 공개한다.
그밖에 FDA는 29일에 미국 아미쿠스 테라퓨틱스가 개발한 희귀 유전질환 폼페병 치료제 'AT-GAA'성분 중 미글루스타트에 대한 NDA 승인 여부를 공개한다. 그후 오는 7월 29일 다른 성분인 재조합 인간 GAA 단백질인 파글루코시다제 알파의 심사 결과를 공개할 예정이다.
 |
| ◇상단의 배너를 누르시면 바이오센추리 (BioCentury)기사 원문을 보실 수 있습니다.(뉴스1 홈페이지 기사에 적용) |
jjsung@news1.kr











![코드쿤스트도 AOMG서 나온다…줄줄이 계약 종료 [공식]](https://image.news1.kr/system/photos/2024/2/21/6492492/no_water.jpg/dims/resize/276/crop/276x184/thumbnail/138x92!/optimize)
![뉴진스 하니, 몽환·러블리 오가는 매력...깜찍 처피뱅 [N화보]](https://image.news1.kr/system/photos/2024/4/26/6618937/no_water.jpg/dims/resize/276/crop/276x184/thumbnail/138x92!/optimize)
![이민정, 이탈리아서 뽐낸 우아한 분위기...미모에 각선미까지 [N화보]](https://image.news1.kr/system/photos/2024/4/25/6616416/no_water.jpg/dims/resize/276/crop/276x184/thumbnail/138x92!/optimize)






