 |
| 신상철 이원다이애그노믹스 대표(중간)와 석도수(가장 왼쪽)·유재형 솔젠트 공동대표. © 뉴스1 |
국내 바이오 진단기업 솔젠트가 지난 달 말 미국 식품의약국(FDA)에 '신종 코로나바이러스 감염증(코로나19)' 진단시약(키트) 허가 신청서를 제출한 것으로 확인됐다. FDA에 긴급사용승인이 아닌 정식 허가신청을 한 국내 진단시약 기업은 솔젠트가 최초다. 보통 의료기기는 허가 신청이 이뤄지면, FDA로부터 수개월 간 검토가 진행된 뒤 승인 여부가 난다. 하지만 최근 미국에서 코로나19 확산세가 커지면서 빠른 시일 내로 허가여부가 나올 것으로 솔젠트측은 관측하고 있다.
솔젠트의 관계사인 이원다이애그노믹스(EDGC, 최대주주사)의 신상철 대표이사는 3일 <뉴스1>과 전화통화에서 "솔젠트는 국내 기업 최초로 지난 3월22일 FDA에 자체 개발한 진단시약을 허가신청했다"며 "현재 미국이 코로나19 위급 상황인 만큼, FDA 설립 역사상 최단 심사기간을 거쳐 2분기 초중순쯤 허가가 이뤄질 것으로 기대한다"고 밝혔다.
◇"FDA 정식 허가시 51개 주정부서 빠른 사용 가능…장기계약도 용이"
솔젠트가 허가신청한 제품은 RT-PCR(유전자 검사법) 장비에 사용하는 진단시약 'DiaPlexTM Novel Coronavirus(2019-nCOV) Detection Kit'다. 앞서 식품의약품안전처로부터 국내 긴급사용 승인과 수출용 허가를 모두 받았다. 긴급사용승인 제도는 위급한 상황에서 정식 임상연구 결과가 없더라도 빠르게 의약품이나 의료기기 등을 사용할 수 있도록 허가해주는 방안이다. 한국과 미국 규제당국에 모두 있는 제도다.
미국에서 긴급사용 승인된 제품은 판매 가능한 기간이 정해져 있고, 그 시점이 종료되면 재승인 절차를 밟아야 한다는 게 신 대표의 설명이다.
하지만 FDA로부터 정식 허가를 받으면 허가취소를 하지 않는 한 계속 판매가 가능하다. 51개 주정부에서도 연방정부 허가한 제품인 만큼 별도 성능 평가를 거치지 않고 해당 진단시약을 더 수월하게 주문, 사용할 수 있다.
정식 허가나 긴급사용 승인이 아니더라도 각 병원이나 검사센터 등 연구소에서 성능 평가를 한 뒤 사용할 수 있는 클리아(CLIA) 인증제도도 있다. 하지만 이 역시 판매 기간에 제한이 있고, 사용하기까지 여러 단계를 거쳐야 하기 때문에 정식 허가 제품에 비해선 사용 제약이 적잖다는 설명이다.
신상철 대표는 "FDA 허가 제품으로 등록되면 51개주에서 별도 성능 평가 없이 진단시약 구매가 훨씬 빨라지면서 용이하고, 재난본부에서 장기간 비축물자로도 사용할 수 있는 가능성이 열린다"고 덧붙였다.
솔젠트는 미국과 영국 등 여러국가 수요 물량을 맞추기 위해 현재 국내 생산량 확대를 계획하고 있다. 지난 2일에는 30만명 검사분량의 진단시약을 폴란드에 선적했다. 이는 피오르트 오스타셰프스키(Piotr Ostaszewski) 주한 폴란드 대사의 긴급 요청에 따른 것이다. 폴란드 총 수출 물량은 이를 포함해 30만명 검사가 가능한 진단시약 3000개다.
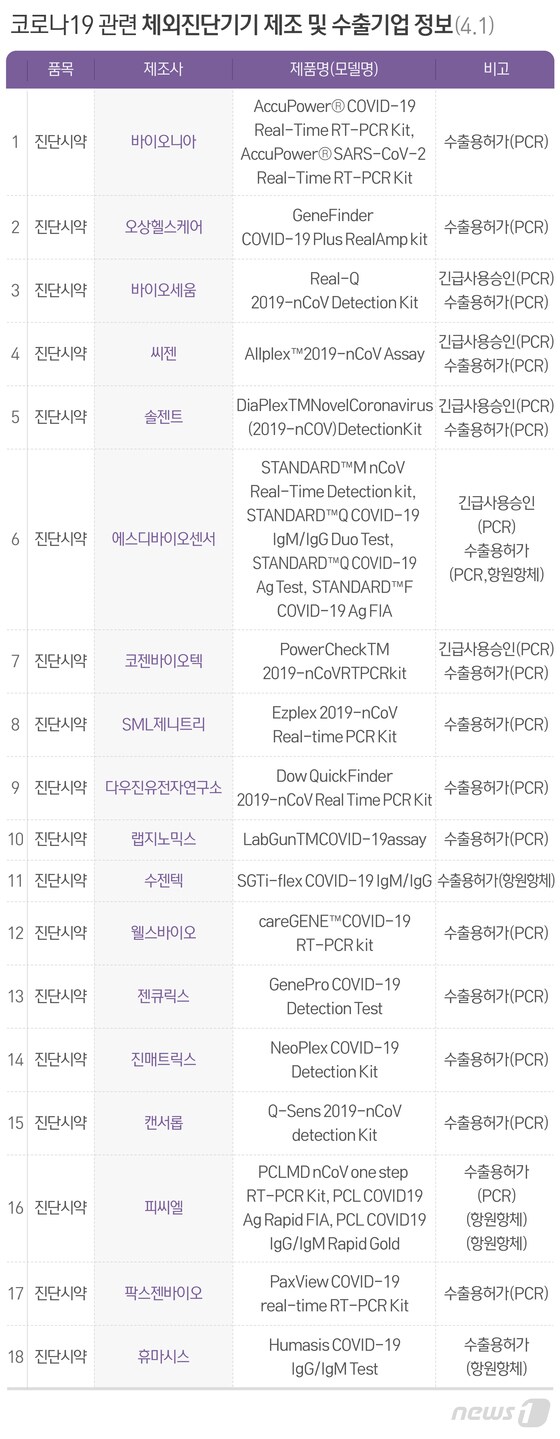
◇국내 18개 업체 개발 24종 수출용 허가…"없어서 못 팔 정도"
솔젠트를 포함한 '코로나19' 국내 진단시약 24종이 식품의약품안전처로부터 수출용 허가를 받아 이미 선적됐거나 수출을 준비 중이다. 우리나라는 '코로나19' 유행이 꺾임세를 보이고 있지만 미국과 유럽 등 많은 나라들은 현재 확산세가 커, 국내 진단시약에 관심이 상당히 높다는 시각이다.
국내 18개 업체가 개발한 진단시약 24종은 RT-PCR부터 항체 신속진단키트, 항원 신속진단키트까지 여러 종류다.
RT-PCR 등 PCR 시약 수출 허가를 받은 기업은 바이오니아와 오상헬스케어, 바이오세움, 씨젠, 솔젠트, 에스디바이오센서, 코젠바이오텍, SML제니트리, 다우진유전자연구소, 랩지노믹스, 웰스바이오, 젠큐릭스, 진매트릭스, 캔서롭, 피씨엘, 팍스젠바이오 등 16곳이다.
이 가운데 씨젠을 비롯한 상당 수 기업이 미국 FDA에 긴급사용 승인을 신청하고 결과를 기다리고 있다. 전세계적으로 많은 물량 주문이 들어와 현재 공급량을 맞추지 못하고 있는 곳들도 적잖다.
관련 기업 중 한 곳은 "공급량이 주문량을 따라가지 못하면서 내부적으로 생산량을 늘리는 게 현재 가장 시급한 상황"이라고 밝혔다.
PCR 방식 외 항체와 항원 신속진단키트도 수출길에 오르고 있다. 우리나라에선 아직 사용을 하지 않지만, 갑자기 많은 확진자들이 생기고 있는 국가들에서 1차적인 확진자 분류 혹은 검사 보완 용도로 관련 제품을 찾고 있다.
이러한 항원, 항체 신속진단키트 수출 허가를 받은 곳은 에스디바이오센서(항원·항체), 피씨엘(항원·항체), 수젠텍(항체), 휴마시스(항체) 등 4곳이다. 에스디바이오센서와 피씨엘은 RT-PCR 시약도 보유하고 있다.
 |
| © News1 최수아 디자이너 |
lys@news1.kr










![[단독] '1988년 8월 18일생' 지드래곤, 8월 전격 컴백…복귀 후 곧 투어도](https://image.news1.kr/system/photos/2023/12/25/6395536/no_water.jpg/dims/resize/276/crop/276x184/thumbnail/138x92!/optimize)
!['쿵푸팬더4', 8일 연속 1위…100만 관객 눈앞 [Nbox]](https://image.news1.kr/system/photos/2024/4/18/6603553/no_water.jpg/dims/resize/276/crop/276x184/thumbnail/138x92!/optimize)

![뉴진스 다니엘, 소파 위 도발 눈빛...탄탄 복근까지 [N화보]](https://image.news1.kr/system/photos/2024/4/16/6599923/no_water.jpg/dims/resize/276/crop/276x184/thumbnail/138x92!/optimize)






